聚乙二醇(PEG)是一種(zhǒng)被(bèi)廣泛應用于蛋白質和多肽等生物聚合物進(jìn)行共價修飾的高分子材料[1]。PEG化修飾(PEGylation)是將(jiāng)PEG共價結合在藥物上,以改善藥物的藥代動力學(xué)、藥效學(xué)和免疫學(xué)特性,從而增強其治療效果的一種(zhǒng)藥物技術[2]。
PEG具有無毒、無免疫原性、無抗原性、水溶性好(hǎo)等優點,是當今最常用的高分子材料之一。PEG化修飾會(huì)改變藥物的物理化學(xué)性質,包括構象、靜電結合、疏水性等。這(zhè)些物理和化學(xué)變化增加了藥物的體内保留時(shí)間,提高血漿半衰期,延長(cháng)吸收時(shí)間,還(hái)能(néng)影響藥物與細胞受體的結合親和力,改善腫瘤靶向(xiàng)性。藥物經(jīng)PEG修飾後(hòu)可減少給藥次數、提高療效、改善耐受性、降低嚴重程度和不良事(shì)件發(fā)生率[3]。同時(shí)PEG還(hái)可以增加蛋白質的溶解度和穩定性,也有利于藥物的生産和儲存。因此PEG常被(bèi)用作藥物傳遞和藥物修飾技術,可以直接與藥物偶聯,或附著(zhe)在藥物表面(miàn)一起(qǐ)封裝于納米材料裡(lǐ)。
自20世紀90年代初以來,聚乙二醇化一直是臨床上最成(chéng)熟的半衰期延長(cháng)技術,30多年來已在人類身上證明了其安全性。PEG化藥物已被(bèi)大多數國(guó)家/地區當局批準供人靜脈、口服和皮膚使用。目前,PEG化修飾可被(bèi)用于修飾蛋白質、多肽、寡核苷酸、抗體片段、有機小分子和納米顆粒等。
PEG在早期研究中被(bèi)認爲是一種(zhǒng)生物惰性材料,不具有免疫原性和抗原性。但最近一些報導顯示長(cháng)期給藥會(huì)使PEG在組織内富集,可能(néng)會(huì)導緻潛在的組織毒性和不良反應[4-6]。小于400 Da的PEG鏈在體内被(bèi)醇脫氫酶代謝爲有毒代謝物,如PEG在體内能(néng)被(bèi)代謝爲相關酸類代謝物,可能(néng)引起(qǐ)危險的高鈣血症和酸中毒[7]。遊離的PEG和PEG化納米載體可以作爲糖原蛋白和細胞色素P450酶抑制劑,從而改變修飾藥物的藥代動力學(xué)[8-12]。另外文獻[13]報道(dào)有識别和結合PEG的抗藥抗體,即抗PEG抗體(APA),包括既存的抗體和治療誘導的抗體。随著(zhe)越來越多的PEG化産品進(jìn)入臨床,一些報道(dào)將(jiāng)抗PEG抗體的産生與治療效果的降低聯系起(qǐ)來,并且在反複給藥後(hòu),報告的不良反應有所增加。據報道(dào)[14]一項III期研究(NCT01848106)因發(fā)生嚴重不良事(shì)件(SAEs)而停止,經(jīng)曆SAEs的受試者都(dōu)比其他受試者具有非常高的預存APA滴度。除了PEG化的蛋白質,聚乙二醇修飾的納米顆粒[15],例如脂質體和膠束,也被(bèi)報道(dào)在動物模型中可刺激産生APA。
因此,充分了解PEG和PEG化藥物的藥代動力學(xué)特點和生物分析,對(duì)評價其總體安全性和促進(jìn)技術發(fā)展具有重要意義。然而,PEG化藥物的結構複雜、内源性幹擾明顯、分析方法有限,是PEG化藥物藥代動力學(xué)研究和生物分析的一大障礙。
本文綜述了PEG結構和PEG化藥物的分類、FDA批準的已上市藥物,并對(duì)PEG化蛋白藥物的藥代動力學(xué)特點、生物分析和免疫原性方法和技術進(jìn)行簡述,讨論了它們在生物基質中PEG化藥物定量分析和免疫原性分析中的優點和局限性。
一、PEG修飾藥物的結構
PEG聚合物是由環氧乙烷聚合而成(chéng),可以構成(chéng)線性或支鏈結構。線性PEG 的分子式爲H-(O-CH2-CH2)n-OH,隻有2 個末端可用于修飾新型偶聯藥物,因此載藥量較低。而支鏈結構在一個或多個端上具有官能(néng)團,如末端呈樹枝結構的支鏈PEG、叉狀PEG和多臂PEG等,從而實現多種(zhǒng)共轭可能(néng)性,且大大增加了載藥量[16]。
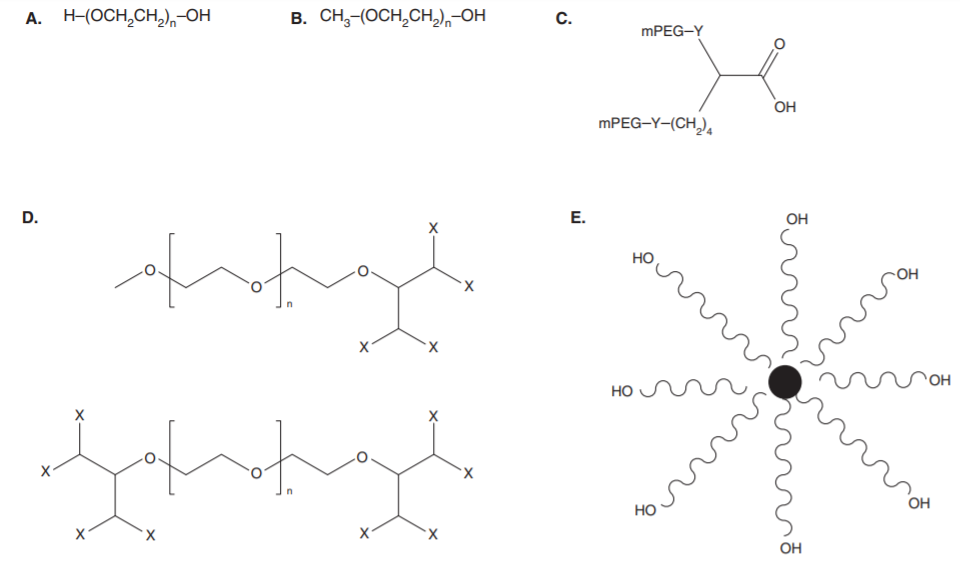
圖1 代表性的PEG結構[17]
注:(A)線性PEG,具有兩(liǎng)個遊離的羟基末端;(B)線性的單甲氧基- PEG(mPEG),一端的一個羟基轉化爲甲氧基;(C)支鏈PEG,兩(liǎng)個線性mPEG與賴氨酸的氨基基團相連,其中Y代表連接劑。(D)叉狀PEG,在一個PEG鏈端或兩(liǎng)個鏈端提供多個近端反應基團,其中X代表官能(néng)團。(E)多臂PEG,攜帶多羟基或官能(néng)團,八臂PEG是以三羟甲基丙烷爲核心。
PEG化藥物一般包括PEG、偶聯的藥物和/或連接劑(Linker)等部分組成(chéng)。PEG化是通過(guò)各種(zhǒng)偶聯的化學(xué)成(chéng)份和/或Linker來優化藥物的溶解性、免疫原性和生物功能(néng)[18]。PEG偶聯的多樣(yàng)性來自于穩定或可水解鍵的使用。
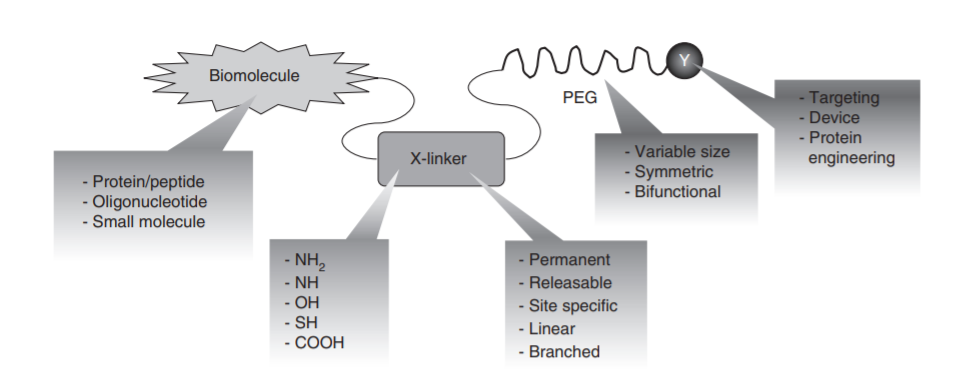
圖2 PEG修飾的主要結構[19]
PEG化技術在上世紀70年代便已出現,最開(kāi)始采用琥珀酰亞胺琥珀酸酯(succinimidyl succinate,ss)作爲Linker,後(hòu)來逐漸演變出多種(zhǒng)Linker。近年來,随著(zhe)研究和開(kāi)發(fā)的不斷深入,出現了PEG雙官能(néng)團異端修飾藥物(heterobifunctional PEG ,X-PEG-Y)等新型PEG化藥物。
表1 PEG化技術變遷
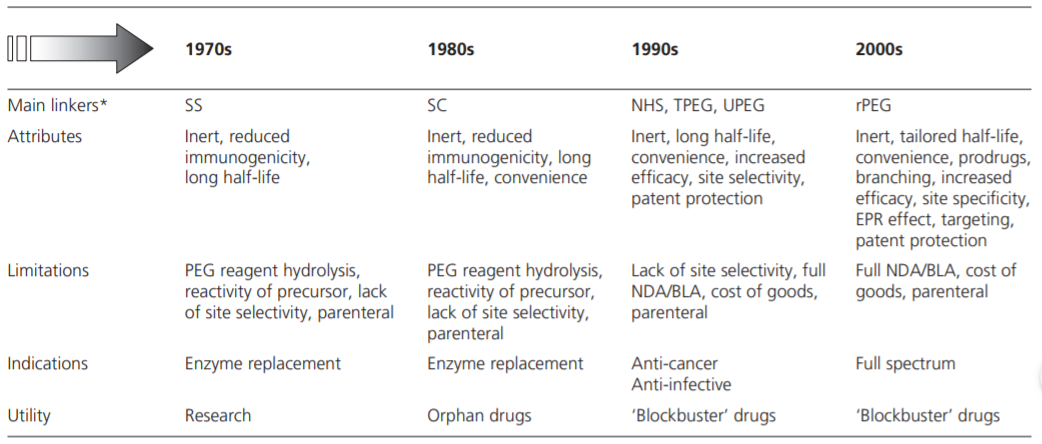
注:SS:琥珀酰亞胺琥珀酸酯succinimidyl succinate);SC:琥珀酰亞胺碳酸酯(succinimidyl carbonate);NHS:N-羟基琥珀酰亞胺(N -hydroxy succinimide);T-PEG:2-巯基噻唑啉-PEG(2-mercaptothiazoline-PEG);UPEG:分支PEG。
二、PEG修飾藥物分類
PEG化修飾在藥物方面(miàn)的應用主要爲PEG化蛋白藥物、PEG化肽鏈型化合物、PEG化小分子藥物、PEG化脂質體等方面(miàn)。
2.1 PEG化蛋白藥物(PEGylated protein drugs)
PEG化蛋白藥物的修飾途徑主要包括氨基修飾(包括N端氨基的酰基化修飾、賴氨酸側鏈氨基的酰基化修飾、N端氨基的烷基化修飾)、羧基修飾、巯基修飾等。國(guó)内外PEG化蛋白藥物的研究主要集中在腺苷脫氨酶、天冬酰胺酶、幹擾素、粒細胞集落刺激因子、白細胞介素等方面(miàn)。PEG化的大分子藥物目前主要用于治療癌症、慢性腎病、肝炎、多發(fā)性硬化症、血友病和胃腸疾病[20]。
2.2 PEG化肽鏈型化合物(PEGylated peptide-based compounds)
多肽一般血漿半衰期短、口服生物利用度較低,這(zhè)是由于體内存在大量的肽酶及其排洩機制,使肽失活、清除。這(zhè)種(zhǒng)不穩定性使得身體能(néng)夠快速調節激素水平以維持體内平衡,但對(duì)許多治療研發(fā)來說(shuō)很不利。另外口服多肽的生物利用度低是由于口腔中消化酶可以分解攝入蛋白質的酰胺鍵,也能(néng)有效地切斷肽激素的相同鍵,同時(shí)肽的高極性和大分子量也嚴重限制了腸通透性。用PEG對(duì)肽進(jìn)行化學(xué)修飾,可以提高肽的多種(zhǒng)理化性能(néng)和藥代動力學(xué)性能(néng),且制造成(chéng)本增加極小。PEG修飾對(duì)肽藥代動力學(xué)的影響具有潛在有益的生物分布變化,包括避免網狀内皮系統(Reticuloendothelial System ,RES)清除,降低免疫原性,減少酶解和腎濾過(guò)損失。這(zhè)些效應可以顯著增加肽在體内的半衰期,間接改善生物利用度,但不會(huì)對(duì)肽與配體的結合和活性産生不利影響。PEG化肽鏈型化合物,如溝降鈣素、表皮生長(cháng)因子,相比于母藥,其半衰期長(cháng),生物活性高。特别是在PEG的定點修飾中,肽化合物比蛋白質更容易獲得。在多肽化合物的PEG化研究中最常見應用的是mPEG。
2.3 PEG化小分子藥物(PEGylated small molecule drugs)
目前許多小分子,尤其是抗腫瘤藥物,可以采用PEG化技術進(jìn)行修飾。PEG負載的小分子可以將(jiāng)其許多優良性質轉移到偶聯物上,使聚合物具有良好(hǎo)的生物相容性。不僅可以改善其溶解性和生物分布,還(hái)可以通過(guò)改變藥物對(duì)酶和重要器官的暴露程度來減少其代謝和毒性。許多抗腫瘤藥物都(dōu)是通過(guò)高分子量PEG修飾來實現對(duì)腫瘤組織的靶向(xiàng)給藥。伊立替康、喜樹堿、多柔比星、紫杉醇等小分子抗腫瘤藥經(jīng)PEG 修飾制備成(chéng)前藥,其溶解性、體内循環半衰期、不良反應等均得到較大改善,同時(shí)具有明顯的增強滲透和滞留效應,對(duì)腫瘤組織的靶向(xiàng)作用也有所提高。
盡管PEG化的蛋白質和多肽取得了顯著的成(chéng)功,但PEG化小分子藥物的開(kāi)發(fā)進(jìn)展有限。這(zhè)可能(néng)是由于天然藥物生物活性的喪失、化學(xué)偶聯和純化困難以及不良反應等問題。如PEG化喜樹堿[21],Enzon制藥公司已于2005年依據2b期臨床試驗的數據,宣布停止進(jìn)一步開(kāi)發(fā)此藥物。臨床試驗結果顯示,與商業配方相比,該結合物具有高度耐受性,毒性顯著降低。然而,該結合物在體内的快速水解導緻了與天然藥物平行的毒性,導緻該結合物的藥物開(kāi)發(fā)失敗。
2.4 PEG化脂質體(PEGylated liposomes)
脂類是兩(liǎng)親分子,分子中有親水(hydrophilic)和疏水(hydrophobic)兩(liǎng)部分。當脂類與水接觸時(shí),分子疏水段與溶劑的不利相互作用導緻脂類的自組裝,通常以脂質體的形式出現。脂質體是由一個或多個同心脂質雙層膜形成(chéng)的球形自封閉結構,其中心和雙層膜之間包裹著(zhe)水相,由天然脂質或合成(chéng)脂質組成(chéng)。20世紀60年代,劍橋大學(xué)Babraham研究所的Alec D Bangham首次發(fā)現了脂質體,并提出了用脂質體作爲藥物傳遞載體的想法。由于脂質體的大小、疏水和親水特性(除了生物相容性),脂質體是很有前途的藥物輸送系統,具有很多優勢。脂質體可以通過(guò)改變藥物吸收、降低代謝、延長(cháng)生物半衰期或降低毒性等手段來改善新藥或已上市藥物的治療指标。藥物分布主要由載體的性質來控制,而不再僅僅由原料藥的理化特性來控制。
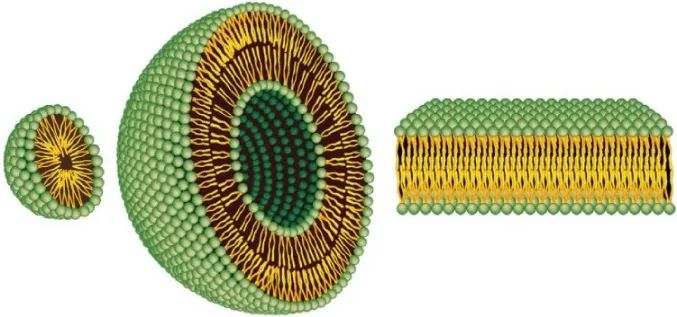
圖3 膠束(左)、脂質體(中)和脂質雙分子層(右)的空間結構
脂質體也存在許多缺點,如生産成(chéng)本高,包封藥物/分子時(shí)易滲漏和融合,磷脂有時(shí)會(huì)發(fā)生氧化和水解反應。脂質體最主要缺陷是快速被(bèi)RES捕獲,導緻半衰期短、溶解度低、穩定期短。而PEG化脂質體(PEG化長(cháng)循環脂質體,PEGylated long-circulating liposomes)可以解決這(zhè)些問題。PEG化後(hòu),PEG鏈通過(guò)在脂質體表面(miàn)建立一層親水保護膜使得脂質體表面(miàn)的親水性增加,與單核吞噬細胞的親和力降低,從而逃避RES的識别,減少脂質體的捕獲,阻止脂質體與其他分子,如各種(zhǒng)血清成(chéng)分的相互作用,故又稱隐形脂質體(stealth liposomes)。該技術應用的一個著名例子是Doxil®,它是由美國(guó)Sequus公司開(kāi)發(fā)的。它是美國(guó)FDA批準的首個脂質體藥物,也是首個納米藥物。
雖然PEG化脂質體具有許多優點,但随著(zhe)研究的深入,PEG化脂質體也帶來了相應的問題。PEG鏈的空間位阻抑制靶細胞攝取脂質體,PEG幹擾基因和蛋白藥物攜帶的pH敏感脂質體(pH-sensitive liposomes,PSL)的“核内逃逸”,導緻這(zhè)些藥物在溶酶體中降解;另外在同一動物體内反複注射PEG化脂質體可引起(qǐ)“血液清除加速”現象。這(zhè)一系列的負面(miàn)影響被(bèi)稱爲“PEG困境”。“PEG困境”給PEG化脂質體的發(fā)展帶來了嚴峻的挑戰。
2.5 其他應用
PEG化親和配體和輔因子用于雙水相分布系統中生物大分子和細胞的純化和分析。PEG化糖可作爲新型藥物的材料和載體。PEG化寡核苷酸能(néng)提高溶解度、對(duì)核酸酶的抗性和細胞膜的通透性。PEG化生物材料可以減少血栓形成(chéng),減少蛋白質和細胞黏連。
三、已上市的PEG化藥物
美國(guó)Enzon制藥公司生産的Adagen是第一個PEG偶聯蛋白,于1990年3月獲得FDA批準進(jìn)入市場。自ADAGEN問世以來,已有數十種(zhǒng)PEG化藥物進(jìn)入臨床,新的PEG化藥物不斷擴大臨床研究管線和藥物專利壽命。大量PEG化蛋白和多肽藥物一直保持著(zhe)良好(hǎo)的發(fā)展勢頭,許多其他藥物也處于臨床試驗或開(kāi)發(fā)階段。
表2 FDA批準的PEG化藥物[22-25]
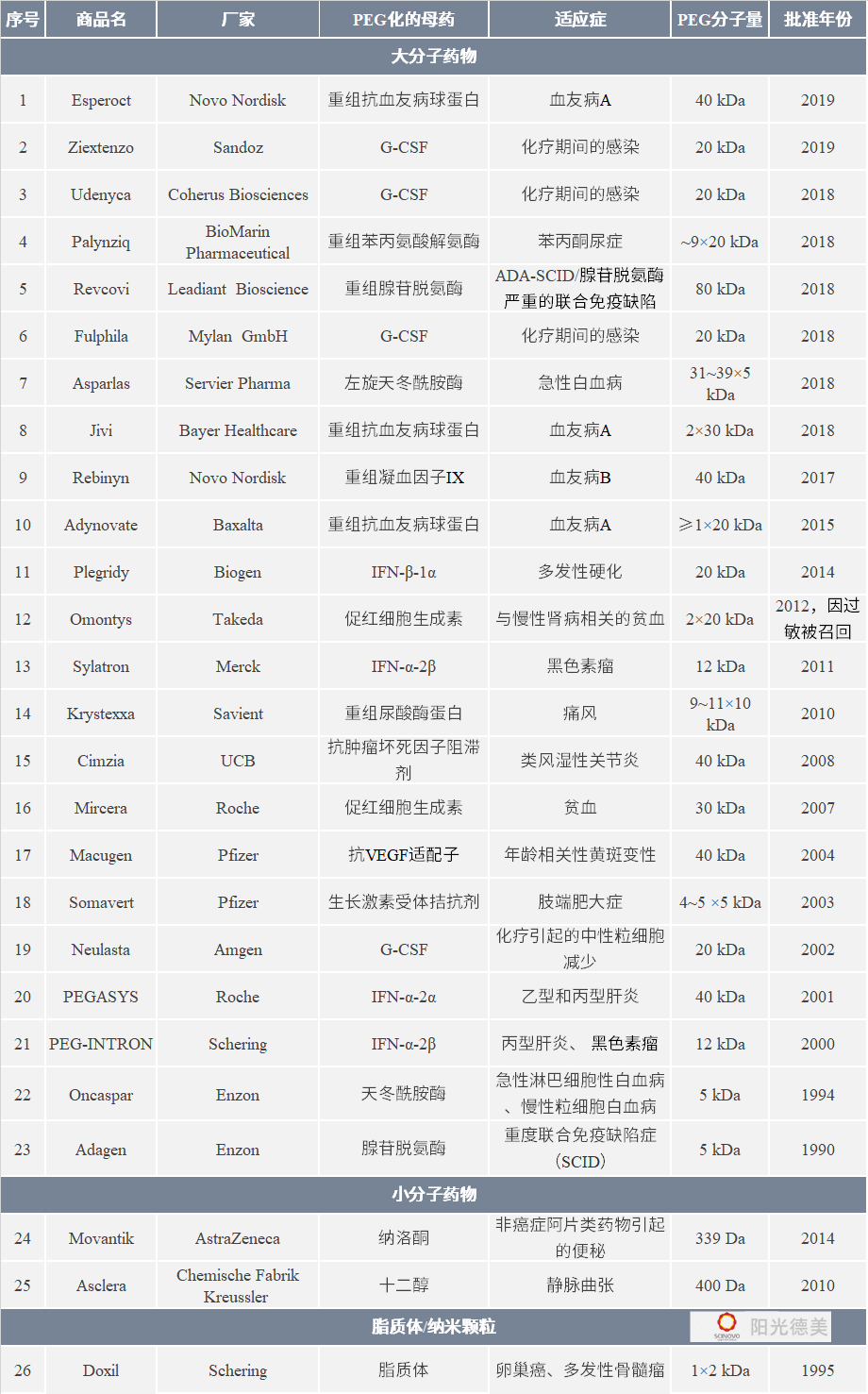
注:含有多個單位PEG的藥物(單位數)×(每個PEG單位的MW),G-CSF:粒細胞集落刺激因子
四、PEG化藥物的優勢
PEG對(duì)蛋白質作用主要體現在兩(liǎng)個方面(miàn):降低腎髒清除率和增強對(duì)蛋白降解的保護作用,兩(liǎng)者都(dōu)降低了藥物的總清除率。因此PEG化蛋白藥物主要的優勢即爲延長(cháng)半衰期。
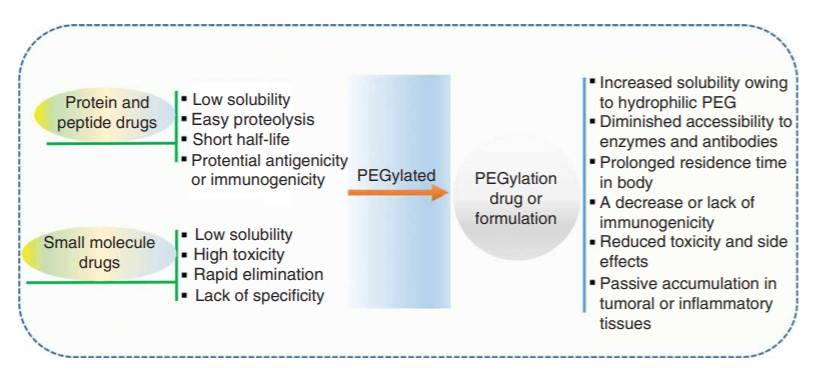
圖4 PEG化的主要優點:改善藥代動力學(xué)、藥理和毒理學(xué)性質[26]
4.1 改善藥效學(xué)特性,降低已知毒性
PEG使抗原決定簇暴露最小化,減少或阻止中和抗體的産生。降低抗原性和免疫原性,最大限度保留生物活性。
對(duì)于毒性與血漿峰值有關的藥物,通過(guò)皮下注射PEG化蛋白可以獲得較平坦的藥代動力學(xué)曲線。某些蛋白質藥物引起(qǐ)的免疫相關不良反應也可以通過(guò)PEG化而減少。
4.2 提高藥物穩定性
在水溶液中,PEG通過(guò)氫鍵與水分子形成(chéng)較厚的水化膜,這(zhè)一水化膜與PEG的柔性鏈(the flexible chain)串聯可以抵抗蛋白質對(duì)底層表面(miàn)的吸附,防止蛋白質聚集和沉澱。修飾PEG與脂類衍生物(酰基、醚、二硫鍵等)之間的連接鍵也可以增加脂質體的穩定性。PEG的柔性鏈可以産生空間位阻效應,保護修飾物不受蛋白酶攻擊,增加修飾的穩定性。PEG化還(hái)可以提高分子的熱穩定性和機械穩定性。
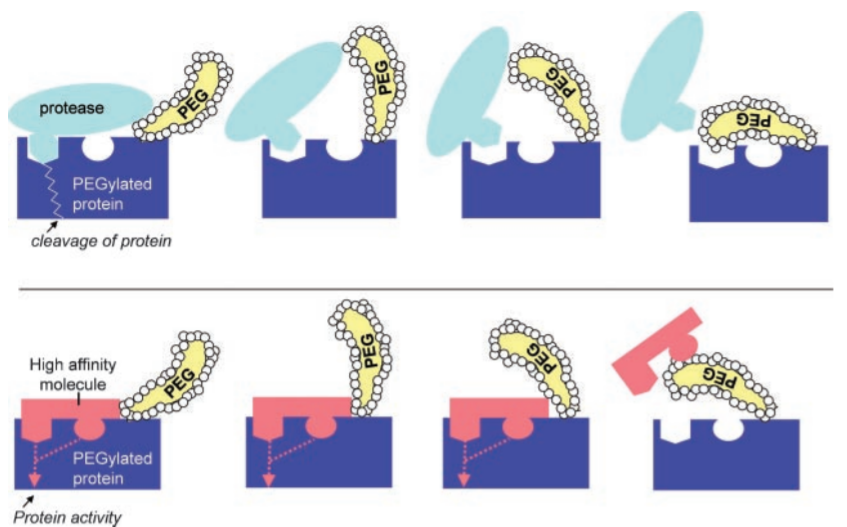
圖5 PEG提供蛋白水解保護的機制模型[16]
注:上圖:血漿蛋白酶與PEG化蛋白的結合被(bèi)高度水化PEG結構域破壞。可移動的PEG結構域産生不同的構型,減少了酶-底物相互作用和蛋白質裂解。下圖:對(duì)于靶向(xiàng)結合分子,更高的親和力增加了相互作用,易産生生物學(xué)效應。
4.3 改善藥物在體内的分布,改善藥代動力學(xué)特性
經(jīng)PEG修飾後(hòu),藥物分子量增加,這(zhè)大大降低了其全身給藥時(shí)的腎小球濾過(guò)作用,降低腎髒清除率,從而減少了經(jīng)尿排洩。同時(shí)逃避RES的清除機制,從而使體内血漿半衰期顯著延長(cháng)、增加藥物在體内的釋放。此外,PEG化藥物改善了體循環的穩定性,延長(cháng)了滞留時(shí)間,有利于改善藥物在體内的分布,特别是有利于大分子藥物在腫瘤和炎症部位的積累。PEG化修飾可以通過(guò)減少皮下注射部位的損失,提高生物利用度。PEG化修飾改變藥物的體内循環時(shí)間,使其免受蛋白水解或代謝的生物失活,因此還(hái)可以通過(guò)減少注射次數來減少劑量,提高患者的依從性。
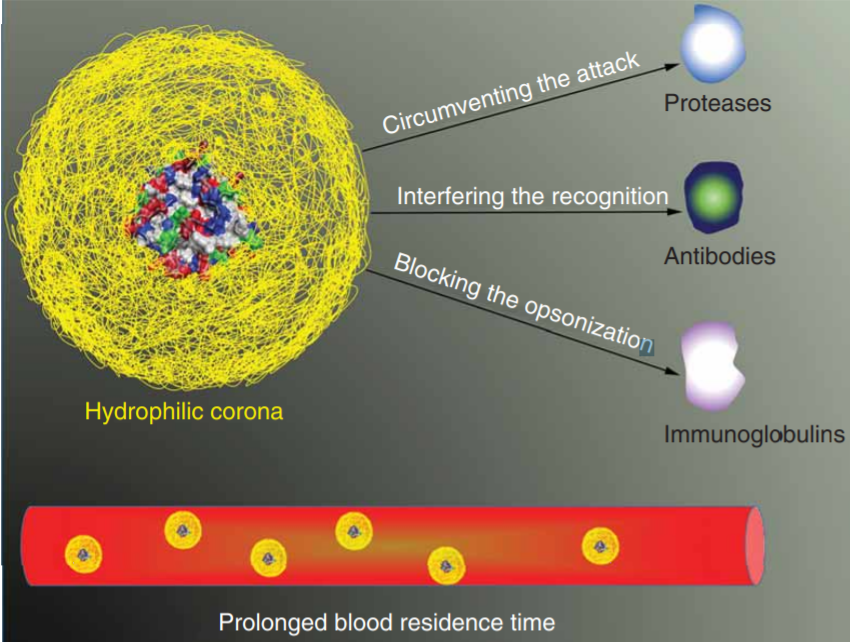
圖6 PEG化蛋白或多肽及其增強藥代動力學(xué)和藥效學(xué)的潛在機制[26]
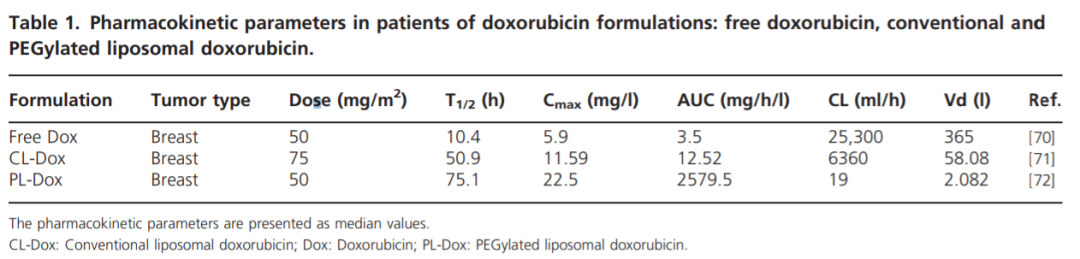
從下表中可以看出PEG化脂質體阿黴素的藥代動力學(xué)參數與遊離阿黴素,傳統脂質體阿黴素的相比,血漿半衰期顯著延長(cháng)。
表3 阿黴素制劑患者的藥代動力學(xué)參數(遊離阿黴素,傳統脂質體阿黴素和PEG化脂質體阿黴素)
4.4 提高溶解度
PEG已被(bèi)發(fā)現可溶于水和許多有機溶劑,如甲苯,二氯甲烷,乙醇和丙酮。該技術的一個應用是使用PEG修飾的抗體對(duì)目标分子或細胞進(jìn)行相分離[27]。
另外,PEG化抗體片段可以濃縮到> 200 mg/mL,爲制劑和給藥提供更多的選擇,如皮下給予高劑量蛋白質。這(zhè)與許多其他治療性抗體的靜脈給藥形成(chéng)對(duì)比。
五、PEG化藥物的藥代動力學(xué)
近年來,大分子偶聯PEG已成(chéng)爲改變多種(zhǒng)藥物藥代動力學(xué)(PK)的有效策略,從而提高其治療潛力。但PEG修飾由于空間位阻幹擾藥物-靶标結合相互作用而導緻結合親和力的喪失。而藥物的藥效學(xué)(PD)特性是通過(guò)受體結合親和力或酶活性等參數在分子水平上進(jìn)行測量。這(zhè)種(zhǒng)藥效的損失被(bèi)藥物較長(cháng)的循環半衰期所抵消,因此PEG的作用是改變藥效學(xué)和藥代動力學(xué)特性之間的平衡,通過(guò)全身暴露增加來補償結合親和力的降低[16]。而由此産生的PK-PD的變化在某些情況下使原本無法開(kāi)發(fā)的藥物得以開(kāi)發(fā),在其他情況下使現有藥物得到改進(jìn)。
PEG聚合物的關鍵特征包括PEG分子量(MW)、分支和末端基團的化學(xué)性質。PEG的修飾位點、PEG的大小、肽與PEG之間的連接等因素都(dōu)會(huì)影響生物活性[28]。末端基團的大小和疏水性是決定結合親和力大小的關鍵。附著(zhe)在聚合物上的蛋白質的動力學(xué)實質上受聚合物本身的動力學(xué)影響。因此,在評價特定的PEG-蛋白偶聯物之前,有必要對(duì)PEG和PEG蛋白偶聯物的血漿動力學(xué)和組織分布分别進(jìn)行分析。
圖7 PEG聚合物的體内藥代動力學(xué)特點[26]
5.1 吸收
PEG爲兩(liǎng)親性物質,帶有可結合多個水分子的長(cháng)鏈,體積較大,可能(néng)不易從胃腸道(dào)環境中進(jìn)入血循環,所以被(bèi)吸收的比例較少[29]。在局部給藥試驗中,PEG的透皮吸收率也取決于它們的分子量大小。低分子量PEG可以低程度地透過(guò)完整皮膚進(jìn)入體内,而分子量高于4000 Da的PEG隻有在皮膚這(zhè)道(dào)保護屏障受損時(shí)才可被(bèi)機體吸收。分子量爲2000的PEG被(bèi)認爲是可以通過(guò)細胞旁運輸或胞吞作用被(bèi)上皮細胞膜吸收的臨界值。
在注射部位,肌肉注射和皮下注射後(hòu)PEG-50在注射位置的保留時(shí)間比PEG-6長(cháng),表明PEG從肌肉注射和皮下注射部位的吸收是分子量依賴性的[30]。然而,對(duì)于腹腔注射,不同分子量的PEG在體内的吸收情況則非常相似。不同分子量PEG藥時(shí)曲線的差異主要是與腎髒血管床的孔徑大小有關。
5.2 分布
PEG化可能(néng)會(huì)改變藥物的組織分布情況,這(zhè)是由于它在修飾母藥引起(qǐ)的物理化學(xué)變化。PEG化藥物在某些組織部位的相對(duì)優先分布可視爲藥物靶向(xiàng)的基礎,而PEG分子量是決定靶向(xiàng)特性的重要因素。循環周期延長(cháng)的大分子會(huì)在腫瘤組織處大量聚集。對(duì)于10 KDa或更大的PEG分子,腫瘤組織的相對(duì)攝取高于正常組織。藥物-PEG -脂質體聯合作用能(néng)顯著改變了母藥的生物分布,與體内靶向(xiàng)腫瘤細胞的特異性結合。有研究[31]表明PEG包被(bèi)的裝載阿黴素的脂質體在腫瘤部位分布顯著增加。此外,用于區域淋巴結成(chéng)像診斷的PEG化納米微球與非PEG化對(duì)照組相比,分布情況發(fā)生了明顯改變,且增強了對(duì)靶向(xiàng)部位的定位。
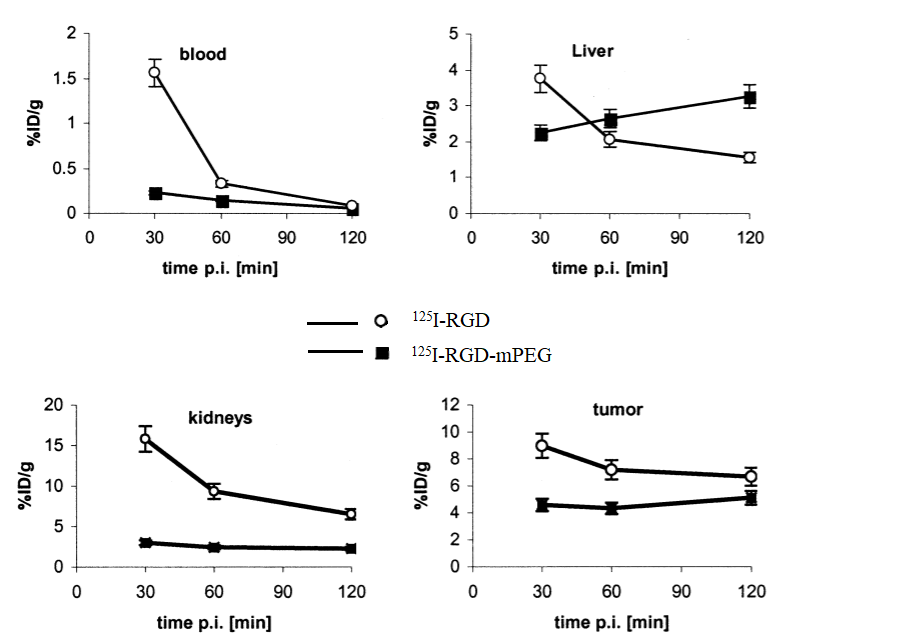
圖8 比較125I-RGD and 125I-RGD-mPEG在攜帶U87MG膠質母細胞瘤的裸鼠中組織分布[32]。RGD:精氨酸-谷氨酸-天冬氨酸;mPEG分子量2 kDa。
5.3 代謝
PEG一般被(bèi)認爲是一種(zhǒng)不可生物降解的聚合物,但有報道(dào)[33-35]明确表明,PEG可以被(bèi)各種(zhǒng)酶氧化降解,如醇脫氫酶、醛脫氫酶、細胞色素p450依賴氧化酶。PEG的I期代謝主要是由醇脫氫酶和醛脫氫酶介導的。分子量對(duì)PEG的I相代謝有重要影響。大約25%的劑量PEG 400在體内代謝,但代謝随著(zhe)MW的增加而減少。分子量小于400的PEG可以通過(guò)乙醇脫氫酶在體内轉化爲有毒的代謝物,而用于藥物或制劑修飾的PEG分子量較大,很少被(bèi)酶降解。
PEG化通過(guò)空間位阻效應屏蔽血漿酶和減少RES吞噬作用兩(liǎng)種(zhǒng)機制對(duì)所附著(zhe)藥物的代謝産生影響。因此藥物經(jīng)PEG修飾後(hòu),粒徑較大的PEG聚合物也可以被(bèi)酶代謝,但生物轉化的速度明顯慢于系統消除。
另外PEG與藥物之間的連接鍵也在母體藥物的代謝中發(fā)揮作用,因爲它們決定了母體藥物的釋放速率。
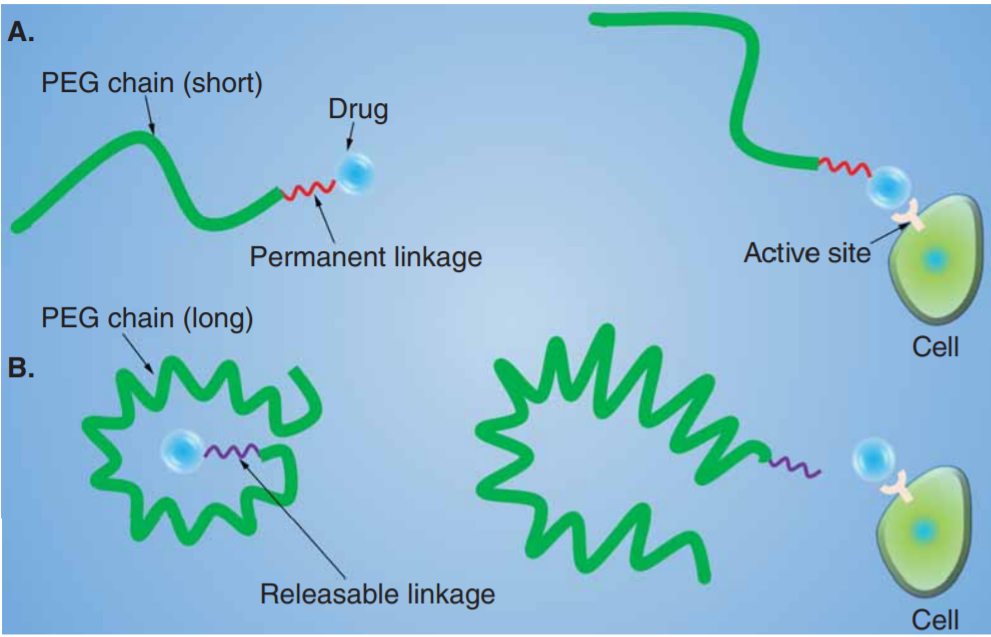
圖9 PEG與藥物之間不同的連接鍵(可釋放的PEG-藥物偶聯物通常被(bèi)認爲是大分子前藥,必須在體内通過(guò)化學(xué)或酶作用轉化爲它們的活性形式;將(jiāng)PEG永久附著(zhe)在小分子上的策略需要使用低分子量的PEG。較大的聚乙二醇可能(néng)由于空間位阻的增加而導緻母藥活性的喪失)[26]
5.4 排洩
PEG化可能(néng)導緻母藥化合物的物理化學(xué)改變,這(zhè)可能(néng)導緻藥物清除過(guò)程的效率降低[31]。一般來說(shuō),治療性蛋白在循環中的壽命非常有限,這(zhè)是由于體内存在有效的消除機制,如蛋白質水解、特定細胞介導的蛋白質降解途徑以及被(bèi)RES捕獲。
PEG的循環半衰期(t1/2)随著(zhe)分子量的增加而增加。例如,當分子量從6 kDa增加到50 kDa 時(shí),t1/2從18分鍾增加到16.5小時(shí)。分子量在40 ~ 50 kDa的PEG可以延緩小分子的腎小球過(guò)濾。如靜脈注射IFN-α後(hòu)系統清除率達到6.6–29.2 lit/hr,當偶聯到5 kDa的線性PEG時(shí),系統清除率顯著降低至2.5-5 lit/hr。
蛋白質清除依賴于生理pH中的蛋白質淨離子電荷、其分子量以及細胞中負責蛋白質攝取的蛋白質特異性受體的存在。分子量小于20 kDa的PEG分子和PEG蛋白偶聯物可通過(guò)尿液被(bèi)清除,而大分子量的PEG蛋白偶聯物通過(guò)尿液和糞便中被(bèi)清除的速度較慢。随著(zhe)粘附在藥物上的PEG分子質量的增加,主要的消除途徑由腎途徑轉向(xiàng)肝途徑。
由于PEG易于消除,PEG在廣泛的劑量範圍内均無顯著的毒性。PEG本身隻在高劑量的非腸道(dào)途徑下産生毒性。當PEG劑量超過(guò)腎髒最大負荷時(shí),腎髒是PEG攻擊的唯一靶器官。有報道(dào)[36]稱靜脈注射勞拉西泮(Ativan)的病人接受了累積劑量爲240 g的PEG 400後(hòu)出現了急性腎小管壞死。
六、PEG化藥物的生物分析
6.1 PK研究
研發(fā)和開(kāi)展一種(zhǒng)有效且安全的PEG-蛋白偶聯物需要在不同階段對(duì)PEG-蛋白偶聯物和PEG進(jìn)行分析。來自臨床前和臨床研究的生物分析數據的質量完全依賴于具有選擇性、敏感性和可重複性的分析方法。爲了在測定血清中PEG-蛋白偶聯物的藥時(shí)曲線,且靈敏度、特異性、重複性和準确性符合接受标準,需要一種(zhǒng)通用且可檢測複雜生物樣(yàng)品中偶聯物的分析方法。生物分析科學(xué)家必須通過(guò)正确的方法驗證來評估哪種(zhǒng)方法最适合待測物。
鑒于PEG化藥物在體内代謝酶或酸堿的作用下會(huì)釋放出遊離藥物,同時(shí)監測體内PEG結合型藥物、遊離型藥物、遊離PEG的濃度實時(shí)變化對(duì)于PEG化藥物的藥效學(xué)和毒理學(xué)研究有著(zhe)非常重要的實際意義[37]。
PEG化藥物可以采用比色法、酶聯免疫法(ELISA)、放射性核素标記法、NMR、液相色譜法、液質聯用(如LC-MS/MS、Q-TOF等)進(jìn)行PK研究[38-39]。
比色法測定 PEG 化藥物對(duì)技術要求較高,而且需要經(jīng)常清洗比色皿和收集PEG 化藥物與雜多酸形成(chéng)的沉澱,較爲耗時(shí)[40]。放射性核素标記法由于标記不易且價格貴等原因限制其應用。NMR靈敏度差,且不适合複雜的生物基質,且NMR檢測的是總體的PEG的濃度,無法區分遊離型和結合型。ELISA法爲PEG化藥物的分析提供了一種(zhǒng)快速、方便的技術,在某些情況下,這(zhè)是其他方法難以實現的。但是PEG化藥物在體内會(huì)經(jīng)曆一系列降解和代謝過(guò)程,ELISA法隻能(néng)檢測活性藥物(與靶标結合),不能(néng)有效的對(duì)PEG化藥物、遊離藥物分子及PEG基團、代謝産物進(jìn)行區分,不适合複雜生物基質中PEG化藥物的分析。而液質聯用法可以檢測總循環藥物,爲PEG化藥物分析提供了可能(néng)的解決方案,以其靈敏和分辨率的優勢得到廣泛應用。但當使用液質聯用法對(duì)PEG化蛋白進(jìn)行生物分析時(shí),也應考慮到來自内源性蛋白質的潛在幹擾成(chéng)分。
6.1.1 ELISA
ELISA是一種(zhǒng)免疫化學(xué)分析技術,用于定量或定性檢測特定蛋白的存在。基于酶聯免疫法進(jìn)行分析的儀器有酶标儀、MSD和Simoa。
將(jiāng)抗PEG抗體的抗原結合片段(Fab)表達于BALB/3T3細胞表面(miàn),用于捕獲PEG化的分子。捕獲的PEG和PEG化分子被(bèi)随後(hòu)加入生物素化的AGP3抗體、鏈黴親和素結合辣根過(guò)氧化物酶(streptavidin-HRP)和ABTS底物定量。此方法對(duì)PEG和PEG偶聯藥物的檢測限爲:PEG 2000爲58.6 ng/mL, PEG 5000爲14.6 ng/mL, PEG 10 kDa和PEG 20 kDa爲3.7 ng/mL。
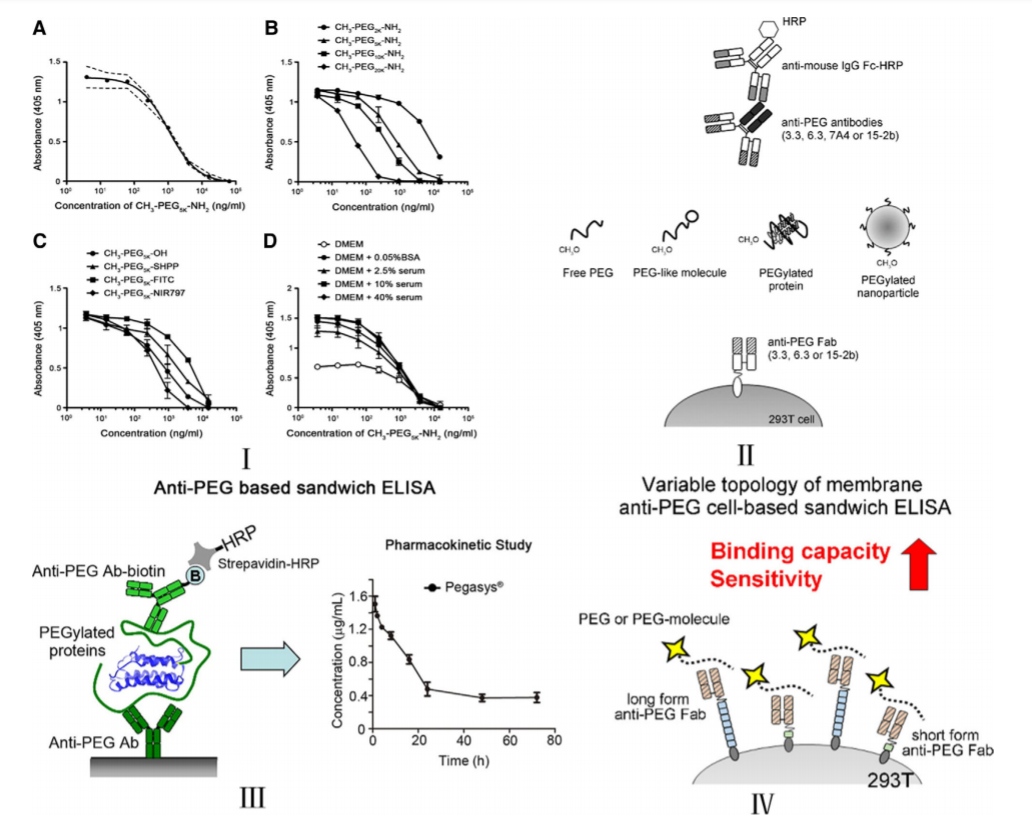
圖10 對(duì)PEG和PEG化分子的生物分析采用不同的ELISA策略:(I)敏感的RPEG細胞競争ELISA;(II)用于定量PEG和PEG化分子的抗PEG細胞三明治酶聯免疫吸附試驗原理圖;(III)抗PEG-based夾心ELISA通用檢測PEG化幹擾素的原理圖;(IV)膜栓抗PEG抗體的可變拓撲增強效應圖,用于定量PEG和PEG化分子的靈敏度。
6.1.2 液質聯用法
液質聯用法是一種(zhǒng)快速發(fā)展的技術,已將(jiāng)生物分析提高到一個新的水平。液質聯用法可以獲得與免疫分析相似的靈敏度,且縮短了方法開(kāi)發(fā)時(shí)間。由于其高靈敏度和選擇性,該技術近年來被(bèi)應用于PEG及PEG化藥物的定量分析。
基于LC-MS /MS的多反應監測(MRM)是一種(zhǒng)靈敏、選擇性的掃描方式,常用于小分子藥物的LC-MS/MS生物分析。在MRM模式下,首先在Q1中選擇分析物的前體離子;所選離子將(jiāng)因此被(bèi)碰撞誘導離解(CID)碎裂;在Q2再次選擇一個或多個特定碎片離子,并將(jiāng)其傳送到Q3檢測。
LC-MS/MS是小分子藥物的常用分析技術,近年來在大分子藥物生物分析方面(miàn)取得了很大的進(jìn)展。但未解離的PEG化蛋白一般超出了檢測範圍。解決這(zhè)一問題可以將(jiāng)目标PEG化蛋白消化成(chéng)低分子量肽。選擇一個高度特異性的肽片段作爲整個PEG -蛋白綴合物定量的替代分析物。
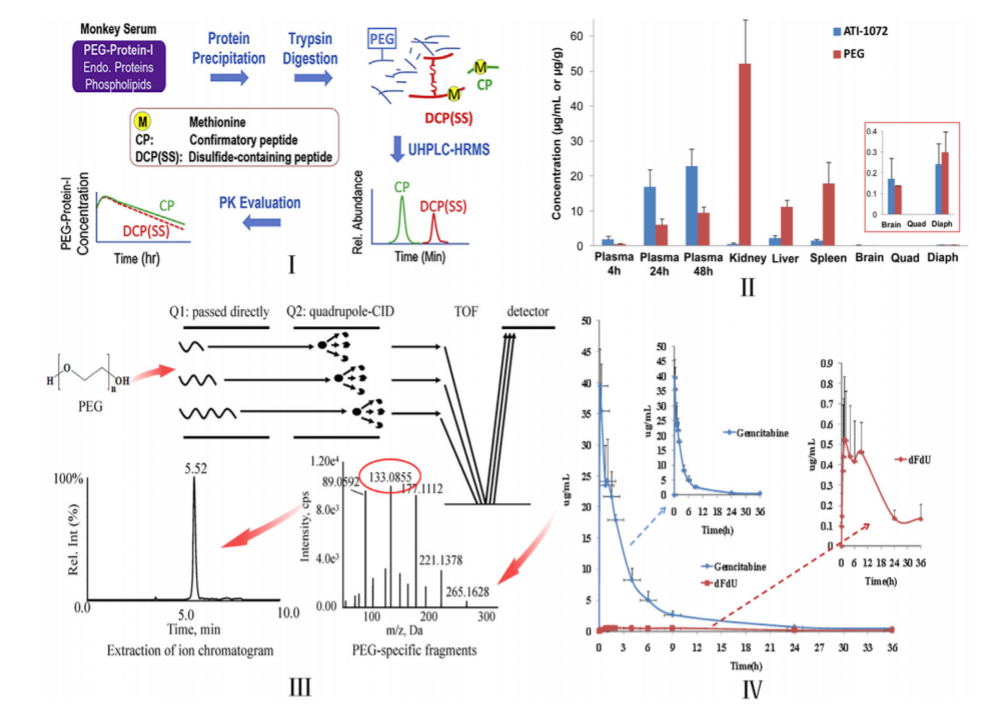
圖11 基于LC-MS /MS的PEGs和PEG化藥物的生物分析。(I)LC-HRMS /MS原理圖,使用含二硫的肽作爲替代分析物用于猴血清中PEG化蛋白的定量。(II)大鼠單次皮下注射ATI-1072後(hòu),40k PEG和ATI-1072在大鼠血漿(給藥後(hòu)4、24和48 h)和組織(給藥後(hòu)48 h)中的平均濃度。(III)采用LC-MSALL技術測定大鼠血漿中PEGs的示意圖。(IV)單次尾靜脈注射PEG化吉西他濱4 mg後(hòu)大鼠血漿中吉西他濱和dFdU的平均濃度-時(shí)間譜(n = 4)
還(hái)有研究[37]采用碰撞誘導解離(CID)技術,建立了基于碰撞能(néng)量CE的CID In-Quadrupole的LC-Q/Q/TOF 串聯質譜方法,運用MSAll 和SWATH(Sequential Windowed Acquisition of All Theoretical Fragment Ion Mass Spectra)掃描模式,通過(guò)監測PEG特異性和藥物特異性的碎片離子來完成(chéng)PEG化藥物及遊離PEG的分析,該方法重現性好(hǎo),靈敏度高,高分辨率的碎片離子選擇能(néng)夠有效的消除幹擾離子的影響,适合複雜生物基質中PEG及PEG化藥物的分析,爲PEG化藥物的設計及安全性、有效性評價提供了強有力的分析工具。下表列出液質聯用定量PEG化藥物的實例。
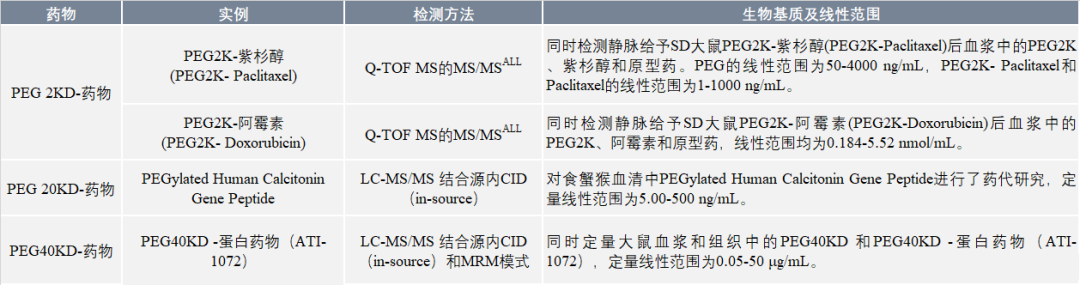
表4 液質聯用方法定量PEG化藥物實例[39, 41-43]
6.2免疫原性
6.2.1 PEG免疫原性産生機制
對(duì)于PEG化的蛋白質和多肽,應密切關注其潛在的免疫原性和抗原性,這(zhè)可能(néng)是由天然蛋白片段和偶聯物可變的分子量引起(qǐ)的。由于部分蛋白片段或外源物種(zhǒng)的引入,PEG化可能(néng)導緻新的表位形成(chéng)。在這(zhè)些抗藥抗體中,抗PEG IgG和IgM已被(bèi)證明能(néng)引起(qǐ)藥物血液清除加速(ABC現象)和過(guò)敏反應(HSRs)導緻的嚴重過(guò)敏症狀,甚至出現緻命的過(guò)敏反應。正确檢測抗PEG抗體(APA)可能(néng)預測PEG化藥物不良免疫反應,從而提高其有效性和安全性。
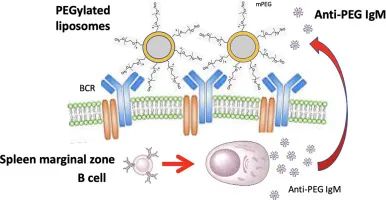
圖12 聚乙二醇脂質體誘導脾邊緣區IgM記憶B細胞産生免疫原性的分子機制[44]
(脂質體上的PEG與表達對(duì)PEG特異性的IgM記憶B細胞上的受體(BCR)結合。脂質體的大小和在其表面(miàn)PEG的結構适合于2~3個特異性B細胞受體,并將(jiāng)它們交聯,從而觸發(fā)細胞内信号級聯,導緻PEG特異性B細胞的增殖并向(xiàng)漿細胞分化,産生并釋放特異性抗PEG IgM到血液中)
6.2.2 PEG免疫原性影響因素
聚乙二醇化藥物的免疫原性取決于聚合物及其修飾藥物的特性,比如PEG鏈結構和長(cháng)度、末端基團、PEG化程度、Linker以及母藥的特性和患者因素等。
PEG鏈結構和長(cháng)度:抗PEG抗體對(duì)PEG的骨幹或末端基團都(dōu)有特異性,兩(liǎng)者具有不同的結合特性。與骨幹的結合親和力較低,結合的抗體數量受PEG長(cháng)度的限制。
末端基團:由羟基PEG偶聯蛋白誘導的抗體對(duì)甲氧基PEG和羟基PEG有相似的親和力,而由甲氧基PEG偶聯蛋白誘導的抗體對(duì)甲氧基PEG的識别能(néng)力強于羟基PEG。在常用的PEG端基中,形成(chéng)抗體的結合親和性按以下順序增加: 羟基(–OH) < 氨基(–NH3+) < 甲氧基(–O-CH3) < 丁氧基 (–O-(CH2)3)-CH3) < 叔丁氧基 (–O-(CH3)3) 。
PEG化程度:不同蛋白質或脂質體的PEG化程度是免疫原性的一個關鍵因素。蛋白質連接的PEG分子通常不超過(guò)3個,而脂質體則有更多的PEG結合位點。有研究[45]通過(guò)調整PEG分子量和偶聯度來探索影響免疫原性的潛在因素。在弗氏佐劑存在的情況下,遊離PEG沒(méi)有或僅有非常弱的免疫原性,而PEG偶聯到大分子上後(hòu)則在免疫動物中誘導産生顯著的抗PEG抗體。PEG對(duì)載體蛋白免疫原性的依賴進(jìn)一步揭示了其半抗原特性。該研究還(hái)發(fā)現修飾的程度是決定PEG-蛋白結合免疫原性的關鍵因素。蛋白質上的PEG鏈越多,抗體反應就(jiù)越弱,這(zhè)可能(néng)是由于PEG鏈增多使抗原表位的掩蔽效果更好(hǎo)。
Linker:PEG與蛋白/載體之間的Linker可能(néng)影響PEG的免疫原性。注射PEG-天冬酰胺酶後(hòu),PEG-天冬酰胺酶之間的酰胺鍵和琥珀酸鍵均能(néng)誘導類似程度的抗PEG抗體[46]。除抗PEG抗體外,有文獻[47]報道(dào)在PEG-天冬酰胺酶高反應性患者中還(hái)觀察到抗琥珀酸連接劑抗體。
母藥的特性:如果PEG修飾的藥物是一種(zhǒng)蛋白,其免疫原性主要通過(guò)T細胞依賴(TD)途徑進(jìn)行,而該蛋白的固有免疫原性協同促進(jìn)了PEG特異性抗體的分泌。如Takeda的Omontys®,修飾的蛋白本身具有免疫原性,但其PEG化制劑誘導的抗PEG免疫反應比非免疫原性蛋白結合的PEG強得多,這(zhè)也是該藥物被(bèi)召回的原因。
患者因素:給藥的途徑和時(shí)間、是否存在預先形成(chéng)的抗體、患者的免疫狀态以及遺傳因素都(dōu)影響PEG化藥物的免疫原性。Chang等人[48]發(fā)現了7個單核苷酸多态性(SNPs),其中最顯著的是定位于免疫球蛋白重鏈可變區基因的“rs12590237” ,這(zhè)些多态性與中國(guó)普通人群中天然(已有的)抗PEG IgM的高患病率和濃度顯著相關。
6.2.3 PEG免疫原性分析方法
由于抗PEG抗體的産生可能(néng)降低PEG化藥物的療效和安全性,因此需要确定臨床相關的抗PEG抗體滴度,以控制患者暴露于PEG化藥物後(hòu)的不良反應風險。
最早應用的檢測方法即凝血試驗。該方法快速、簡單,但靈敏度較低。爲了提高靈敏度,可以采用Western blot、聲膜微粒子技術(AMMP)、酶免疫吸附法(ELISA)和流式細胞術等方法,通過(guò)酶反應或熒光對(duì)信号進(jìn)行放大。然而,這(zhè)些技術通常不是絕對(duì)定量的,并且檢測限取決于實驗條件。表面(miàn)等離子體共振技術(SPR)具有超靈敏、定量、快速的優點,但由于需要特殊而昂貴的儀器和試劑,這(zhè)種(zhǒng)方法并不常用。
下表中列出多種(zhǒng)可用于分析PEG的免疫原性的技術,它們的主要特點已按靈敏度增加的順序列出。
表5 各種(zhǒng)PEG免疫原性分析方法的特點
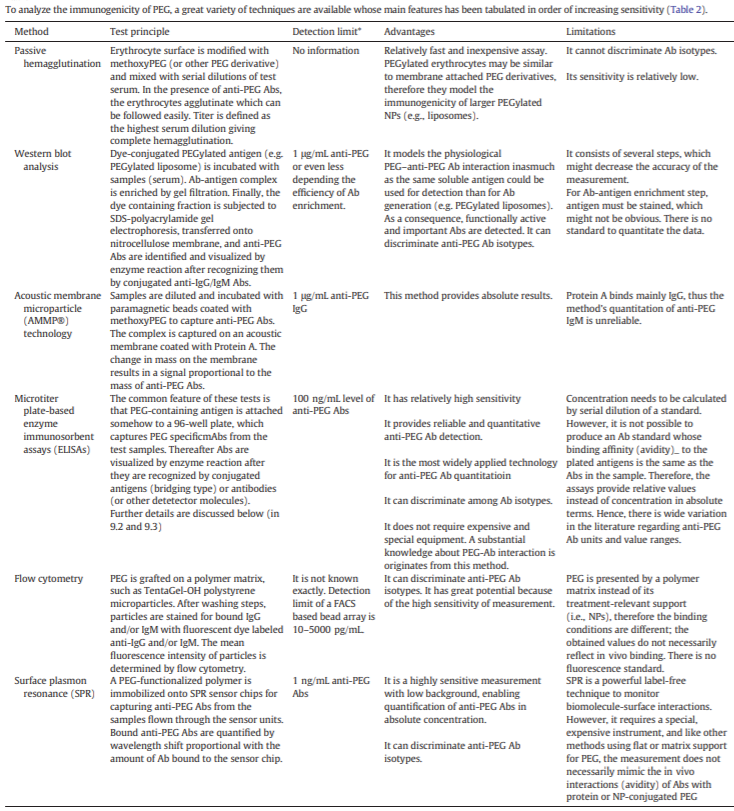
ELISA由于具有較高的靈敏度和半定量抗體水平的能(néng)力,是目前應用最廣泛的抗PEG抗體檢測技術。在直接抗PEG ELISA法中,通過(guò)酶偶聯的宿主IgG或IgM特異性抗體識别血清或血漿中的PEG特異性抗體,并與PEG包被(bèi)的表面(miàn)結合,産生顔色反應。在橋聯免疫原性ELISA方法中,PEG特異性結合抗PEG抗體是通過(guò)結合抗原檢測,而不是抗宿主IgG或IgM[49]。由于抗PEG抗體的雙價或多價性,這(zhè)些抗體被(bèi)夾在兩(liǎng)層PEG抗原之間。第一個抗原包被(bèi)在表面(miàn)用于捕獲,第二個通常是生物素化抗原,與樣(yàng)品一起(qǐ)預孵育,最終通過(guò)鏈黴親和素-酶結合物進(jìn)行檢測。當檢測嵌合的、人源化的或全人源的單克隆抗體類藥物的免疫原性時(shí),橋式ELISA比直接ELISA的優勢更明顯,因爲直接法不能(néng)排除結合的抗人IgG或IgM與闆結合抗體藥物的交叉反應性。但對(duì)于抗PEG抗體不存在此類情況,橋聯法涉及更多的步驟,直接ELISA法更有優勢。抗PEG酶聯免疫吸附法的一個主要局限性在于,由于抗體對(duì)不同PEG化制劑在體内和體外試驗系統的反應能(néng)力可能(néng)存在差異,因此其在體内條件下的有效性值得懷疑。
七、結語
PEG作爲生物偶聯聚合物在藥物治療中的應用日益廣泛。PEG化藥物在近年來取得了長(cháng)足的進(jìn)展,随著(zhe)生物治療領域的擴大,PEG化藥物的出現有望繼續加速。目前PEG化修飾已廣泛應用于改善治療藥物的藥動學(xué)性質,相信在不遠的未來,随著(zhe)修飾技術的不斷完善,會(huì)有越來越多優秀的PEG化藥物出現,爲患者提供更多更好(hǎo)的治療選擇。全面(miàn)了解PEG修飾藥物的藥代動力學(xué)、生物分析,對(duì)于設計更高效、靶向(xiàng)性更好(hǎo)的PEG化藥物和更好(hǎo)地控制不良反應具有重要意義。
參考文獻
[1]. Zhang Z, Zhang Y, Song S, et al. Recent advances in the bioanalytical methods of polyethylene glycols and PEGylated pharmaceuticals[J]. Journal of Separation Science, 2020, 43(9-10): 1978-1997.
[2]. Kang, Jung & Deluca, Patrick & Lee, Kang.. Emerging PEGylated drugs[J]. Expert opinion on emerging drugs. 2009(14). 363-80.
[3]. Becker, R., Dembek, C., White, L. A., & Garrison, L. P. The cost offsets and cost–effectiveness associated with pegylated drugs: a review of the literature[J]. Expert Review of Pharmacoeconomics & Outcomes Research, 2012, 12(6), 775–793.
[4]. Longley, C. B., Zhao, H., Lozanguiez, Y. L., Conover, C. D., Biodistribution and excretion of radiolabeled 40 kDa polyethylene glycol following intravenous administration in mice[J]. Pharm. Sci. 2013, 102, 2362–2370.
[5]. Hu, X., Olivier, K., Polack, E., et al. In vivo pharmacology and toxicology evaluation of polyethylene glycol-conjugated interferon beta-1a[J]. Pharmacol. Exp. Ther. 2011, 338, 984–996.
[6]. Sari Gokay, S., Celik, T., Yusuf Sari, M., et al. Urticaria as a rare side effect of polyethylene glycol-3350 in a child: case report[J]. Acta. Clin. Croat. 2018, 57, 187–189.
[7]. Webster, R., Didier, E., Harris, P., et al. PEGylated proteins: evaluation of their safety in the absence of definitive metabolism studies [J]. Drug. Metab. Dispos. 2007, 35, 9–16.
[8]. Johnson, B. M., Charman, W. N., Porter, C. J., An in vitro examination of the impact of polyethylene glycol 400, Pluronic P85, and vitamin E d-alpha-tocopheryl polyethylene glycol 1000 succinate on P-glycoprotein efflux and enterocyte-based metabolism in excised rat intestine[J]. AAPS. Pharm. Sci. 2002, 4, E40.
[9]. Buda, G., Ricci, D., Huang, C. C., et al. Polymorphisms in the multiple drug resistance protein 1 and in P-glycoprotein 1 are associated with time to event outcomes in patients with advanced multiple myeloma treated with bortezomib and pegylated liposomal doxorubicin[J]. Ann. Hematol. 2010, 89, 1133–1140.
[10]. Hugger, E. D., Novak, B. L., Burton, P. S., et al. A comparison of commonly used polyethoxylated pharmaceutical excipients on their ability to inhibit P-glycoprotein activity in vitro[J]. Pharm. Sci. 2002, 91, 1991–2002.
[11]. Shen, Q., Lin, Y., Handa, T., et al. Modulavtion of intestinal Pglycoprotein function by polyethylene glycols and their derivatives by in vitro transport and in situ absorption studies. Int[J]. Pharm. 2006, 313, 49–56.
[12]. Shah, D., Paruchury, S., Matta, M., et al. A systematic evaluation of solubility enhancing excipients to enable the generation of permeability data for poorly soluble compounds in Caco-2 model [J]. Drug. Metab. Lett. 2014, 8, 109–118.
[13]. McSweeney MD, Wessler T, Price LSL, et al. A minimal physiologically based pharmacokinetic model that predicts anti-PEG IgG-mediated clearance of PEGylated drugs in human and mouse [J]. Control Release. 2018;284:171-178.
[14]. Povsic TJ, Lawrence MG, Lincoff AM, et al. Pre-existing anti-PEG antibodies are associated with severe immediate allergic reactions to pegnivacogin, a PEGylated aptamer[J]. Allergy Clin Immunol. 2016 Dec; 138(6):1712-1715.
[15]. Shimizu T, Mima Y, Hashimoto Y, et al. Anti-PEG IgM and complement system are required for the association of second doses of PEGylated liposomes with splenic marginal zone B cells[J]. Immunobiology. 2015;220:1151–1160.
[16]. Fishburn, C. S. The Pharmacology of PEGylation: Balancing PD with PK to Generate Novel Therapeutics[J]. Journal of Pharmaceutical Sciences, 2008, 97(10), 4167–4183.
[17]. Bailon, P., & Won, C.-Y. PEG-modified biopharmaceuticals [J]. Expert Opinion on Drug Delivery, 2009.6(1), 1–16.
[18]. G.E. Francis, D. Fisher, C. Delgado, et al. PEGylation of cytokines and other therapeutic proteins and peptides: the importance of biological optimisation of coupling techniques[J]. Int. J. Hematol., 1998 (68), pp. 1-18.
[19]. Bailon, P., & Won, C.-Y. PEG-modified biopharmaceuticals. Expert Opinion on Drug Delivery, 2009, 6(1), 1–16.
[20]. https://www.biochempeg.com/article/70.html.
[21]. 來源于https://drugs.ncats.io/drug/ZY7ZTE7LFH
[22]. Magdalena Swierczewska, Kang Choon Lee & Seulki Lee. What is the future of PEGylated therapies?[J], Expert Opinion on Emerging Drugs, 2015, 20:4, 531-536, DOI: 10.1517/14728214.2015.1113254
[23]. Gergely Tibor Kozma, Taro Shimizu, Tatsuhiro Ishida, Janos Szebeni, Anti-PEG antibodies: Properties, formation, testing and role in adverse immune reactions to PEGylated nano-biopharmaceuticals[J].Advanced Drug Delivery Reviews, 2020, Volumes 154–155: 163-175, https://doi.org/10.1016/j.addr.2020.07.024. (https://www.sciencedirect.com/science/article/pii/S0169409X20301083)後(hòu)面(miàn)有
[24]. https://www.biochempeg.com/article/58.html
[25] .FDA官網.
[26]. Zhang, X., Wang, H., Ma, Z., & Wu, B.. Effects of pharmaceutical PEGylation on drug metabolism and its clinical concerns[J]. Expert Opinion on Drug Metabolism & Toxicology, 2014, 10(12), 1691–1702.
[27]. Chapman, A. P.. PEGylated antibodies and antibody fragments for improved therapy: a review[J]. Advanced Drug Delivery Reviews, 2002, 54(4), 531–545.
[28]. Na, Dong Hee & Lee, Kang & Deluca, Patrick.. PEGylation of Octreotide: II. Effect of N-terminal Mono-PEGylation on Biological Activity and Pharmacokinetics[J]. Pharmaceutical research. 2005, 22. 743-9. 10.1007/s11095-005-2590-y.
[29]. 周曉彤. 聚乙二醇飛行時(shí)間質譜分析方法及其臨床前藥代動力學(xué)研究[D]. 顧景凱. 吉林大學(xué), 2016.
[30]. Mehvar, Reza. Modulation of the pharmacokinetics and pharmacodynamics of proteins by polyethylene glycol conjugation [J ]. Pharm Pharm Sci, 2000, 3.1: 125-136.
[31]. Hamidi M, Azadi A, Rafiei P. Pharmacokinetic consequences of pegylation[J]. Drug delivery, 2006, 13(6): 399-409.
[32]. Chen, X., Park, R., Shahinian, A. H., et al. Pharmacokinetics and tumor retention of 125I-labeled RGD peptide are improved by PEGylation[J]. Nuclear Medicine and Biology, 2004, 31(1), 11–19. doi:10.1016/j.nucmedbio.2003.07.003.
[33]. Kawai, F., Microbial degradation of polyethers[J]. Appl. Microbiol. Biotechnol. 2002, 58, 30-38.
[34]. Mehvar, R., Modulation of the pharmacokinetics and pharmacodynamics of proteins by polyethylene glycol conjugation[J]. Pharm. Pharm. Sci. 2000, 3, 125-136.
[35]. Beranova, M., Wasserbauer, R., Vancurova, D., Stifter, M. et al., Effect of cytochrome P-450 inhibition and stimulation on intensity of polyethylene degradation in microsomal fraction of mouse and rat livers[J]. Biomaterials 1990, 11, 521-524.
[36]. Laine GA, Hossain SM, Solis RT, et al. Polyethylene glycol nephrotoxicity secondary to prolonged high-dose intravenous lorazepam[J]. Ann Pharmacother 1995;29:1110-14.
[37]. 尹磊,周曉彤,顧景凱. PEG化抗腫瘤藥物的體内精準質譜分析方法研究[A]. 中國(guó)藥學(xué)會(huì).2016年中國(guó)藥學(xué)大會(huì)暨第十六屆中國(guó)藥師周論文集[C].中國(guó)藥學(xué)會(huì):中國(guó)藥學(xué)會(huì),2016:2.
[38]. Markman J L , Rekechenetskiy A , Holler E , et al. Nanomedicine therapeutic approaches to overcome cancer drug resistance.[J]. Advanced Drug Delivery Reviews, 2013, 65(13-14):1866-1879.
[39]. Jiachang Gong, Xiaomei Gu, William E, et al., Quantitative Analysis of Polyethylene Glycol (PEG) and PEGylated Proteins in Animal Tissues by LC-MS/MS Coupled with In-Source CID[J]. Analytical Chemistry, 2014, 86, 7642−7649.
[40]. 孫和平. PEG化紫杉醇的納米藥代動力學(xué)研究[D]. 顧景凱. 吉林大學(xué). 2017.
[41]. Sun H , Zhang Q , Zhang Z , et al. Simultaneous quantitative analysis of polyethylene glycol (PEG), PEGylated paclitaxel and paclitaxel in rats by MS/MSALL, technique with hybrid quadrupole time-of-flight mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2017, 145:255-261.
[42]. Yin L , Su C , Ren T , et al. MSAll strategy for comprehensive quantitative analysis of PEGylated-doxorubicin, PEG and doxorubicin by LC-high resolution q-q-TOF mass spectrometry coupled with all window acquisition of all fragment ion spectra[J]. The Analyst, 2017:10.1039.C7AN00470B.
[43]. Li H , Rose M J , Holder J R , et al. Direct Quantitative Analysis of a 20 kDa PEGylated Human Calcitonin Gene Peptide Antagonist in Cynomolgus Monkey Serum Using In-Source CID and UPLC-MS/MS[J]. Journal of the American Society for Mass Spectrometry, 2011, 22(9):1660-1667.
[44]. Kozma, G., Shimizu, T., Ishida, T., & Szebeni, J.. Anti-PEG antibodies: Properties, formation and role in adverse immune reactions to PEGylated nano-biopharmaceuticals[J]. Advanced Drug Delivery Reviews. doi:10.1016/j.addr.2020.07.024.
[45]. Zhang P, Sun F, Liu S, et al. Anti-PEG antibodies in the clinic: Current issues and beyond PEGylation[J]. J Control Release. 2016;244(Pt B):184-193. doi:10.1016/j.jconrel.2016.06.040.
[46]. S.M. Poppenborg, J. Wittmann, W. Walther, et al.Impact of anti-PEG IgM antibodies on the pharmacokinetics of pegylated asparaginase preparations in mice[J]. Eur. J. Pharm. Sci., 91 (2016), pp. 122-130.
[47]. R. Kloos, I.M. van der Sluis, E. Mastrobattista, et al.Acute lymphoblastic leukaemia patients treated with PEGasparaginase develop antibodies to PEG and the succinate linker[J].
Br. J. Haematol., 189 (2020), pp. 442-451.
[48]. C.J. Chang, C.H. Chen, B.M. Chen, et al. A genome-wide association study identifies a novel susceptibility locus for the immunogenicity of polyethylene glycol[J].Nat. Commun., 8 (2017), p. 522.
[49]. Y. Liu, H. Reidler, J. Pan, et al. A double antigen bridging immunogenicity ELISA for the detection of antibodies to polyethylene glycol polymers[J]. J. Pharmacol. Toxicol. Methods, 64 (2011), pp. 238-245.
原文鏈接:https://med.sina.com/article_detail_103_2_101391.html
研發(fā)及郵寄地址:中國(guó)深圳市坪山區錦繡中路14号C棟4層
公司地址:深圳市坪山區坑梓街道(dào)金沙社區金輝路14号生物醫藥創新産業園區10号樓1519(在深圳市坪山區坑梓街道(dào)錦繡中路14号深福保現代光學(xué)廠區C棟4層從事(shì)生産經(jīng)營活動)
傳真:0755-82928936
郵箱:sales@szpolymers.com
